1. Ingall T. Stroke: incidence, mortality, morbidity and risk. J Insur Med 2004;36:143-152.

2. Grysiewicz RA, Thomas K, Pandey DK. Epidemiology of ischemic and hemorrhagic stroke: incidence, prevalence, mortality, and risk factors. Neurol Clin 2008;26:871-895.


8. Miao M, Xiang L. Pharmacological action and potential targets of chlorogenic acid. Adv Pharmacol 2020;87:71-88.


10. Shi M, Sun F, Wang Y, Kang J, Zhang S, Li H. CGA restrains the apoptosis of A╬▓25-35-induced hippocampal neurons. Int J Neurosci 2020;130:700-707.


12. Zheng Y, Li L, Chen B, Fang Y, Lin W, Zhang T, Feng X, Tao X, Wu Y, Fu X, Lin Z. Chlorogenic acid exerts neuroprotective effect against hypoxia-ischemia brain injury in neonatal rats by activating Sirt1 to regulate the Nrf2-NF-╬║B signaling pathway. Cell Commun Signal 2022;20:84.



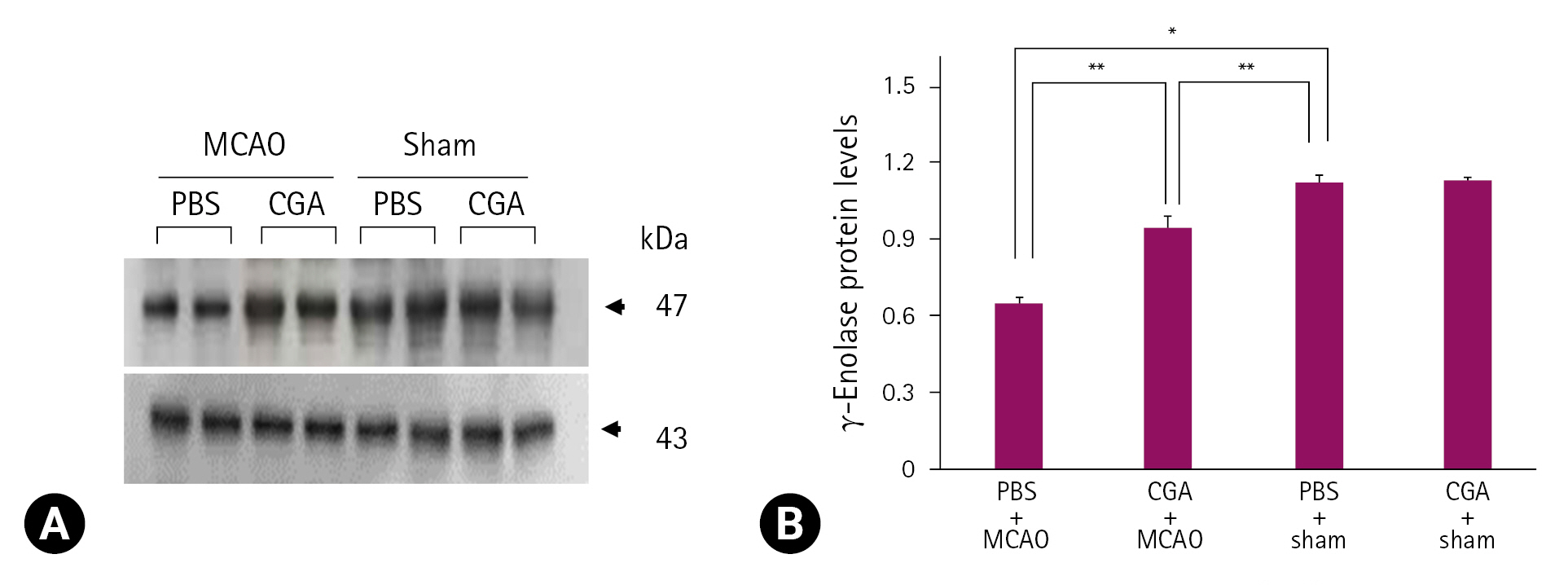
13. Shah MA, Kang JB, Park DJ, Kim MO, Koh PO. Chlorogenic acid alleviates neurobehavioral disorders and brain damage in focal ischemia animal models. Neurosci Lett 2021;760:136085.


14. Schmechel DE, Brightman MW, Marangos PJ. Neurons switch from non-neuronal enolase to neuron-specific enolase during differentiation. Brain Res 1980;190:195-214.


15. Rider CC, Taylor CB. Enolase isoenzymes in rat tissues: electrophoretic, chromatographic, immunological and kinetic properties. Biochim Biophys Acta 1974;365:285-300.


17. Schmechel D, Marangos PJ, Zis AP, Brightman M, Goodwin FK. Brain endolases as specific markers of neuronal and glial cells. Science 1978;199:313-315.


18. Hattori T, Ohsawa K, Mizuno Y, Kato K, Kohsaka S. Synthetic peptide corresponding to 30 amino acids of the C-terminal of neuron-specific enolase promotes survival of neocortical neurons in culture. Biochem Biophys Res Commun 1994;202:25-30.


19. Hattori T, Takei N, Mizuno Y, Kato K, Kohsaka S. Neurotrophic and neuroprotective effects of neuron-specific enolase on cultured neurons from embryonic rat brain. Neurosci Res 1995;21:191-198.


23. Lee K, Lee JS, Jang HJ, Kim SM, Chang MS, Park SH, Kim KS, Bae J, Park JW, Lee B, Choi HY, Jeong CH, Bu Y. Chlorogenic acid ameliorates brain damage and edema by inhibiting matrix metalloproteinase-2 and 9 in a rat model of focal cerebral ischemia. Eur J Pharmacol 2012;689:89-95.


25. Li X, Blizzard KK, Zeng Z, DeVries AC, Hurn PD, McCullough LD. Chronic behavioral testing after focal ischemia in the mouse: functional recovery and the effects of gender. Exp Neurol 2004;187:94-104.


27. Halliwell B. Oxidative stress and neurodegeneration: where are we now? J Neurochem 2006;97:1634-1658.


28. Shah MA, Kang JB, Park DJ, Kim MO, Koh PO. Chlorogenic acid alleviates cerebral ischemia-induced neuroinflammation via attenuating nuclear factor kappa B activation. Neurosci Lett 2022;773:136495.


29. Cronberg T, Rundgren M, Westhall E, Englund E, Siemund R, Ros├®n I, Widner H, Friberg H. Neuron-specific enolase correlates with other prognostic markers after cardiac arrest. Neurology 2011;77:623-630.


30. Takei N, Kondo J, Nagaike K, Ohsawa K, Kato K, Kohsaka S. Neuronal survival factor from bovine brain is identical to neuron-specific enolase. J Neurochem 1991;57:1178-1184.


31. Sung JH, Kim MO, Koh PO. Proteomic identification of proteins differentially expressed by nicotinamide in focal cerebral ischemic injury. Neuroscience 2011;174:171-177.


34. Watanabe T, Arai Y, Mitsui Y, Kusaura T, Okawa W, Kajihara Y, Saito I. The blood pressure-lowering effect and safety of chlorogenic acid from green coffee bean extract in essential hypertension. Clin Exp Hypertens 2006;28:439-449.













 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print